-
2016年中國醫藥改革政策梳理、醫藥行業投資前景預測
2016/5/25 11:06:09 來源:中國產業發展研究網 【字體:大 中 小】【收藏本頁】【打印】【關閉】
核心提示:為了解決我國藥品領域監管不夠合理、供給側結構性矛盾等諸多問題,從2013 年起,我國國務院及國家食品藥品監督管理局已經啟動了一系列改革。三年間,相關部門共公布了14 條政策,改革也按照“啟動——試點&md為了解決我國藥品領域監管不夠合理、供給側結構性矛盾等諸多問題,從2013 年起,我國國務院及國家食品藥品監督管理局已經啟動了一系列改革。三年間,相關部門共公布了14 條政策,改革也按照“啟動——試點——推廣”的順序逐步推進,目前步入了真正的深水區。我們判斷,2016 年將成為幾年以來持續的改革政策開始見效的關鍵時期,不僅對民生用藥質量的提高有顯著影響,更對醫藥企業的生存和發展、藥品行業未來發展格局帶來重大變革。
一、啟用新GMP 標準,對藥企硬件設施要求顯著提高
1、新GMP 標準進一步提高了藥企生產設施的門檻
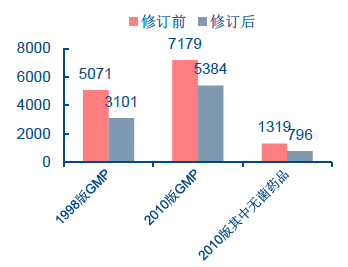
目前我國藥品注冊和生產環節最重要的監管手段是GMP 認證制度。它的全稱是《藥品生產質量管理規范》(Good Manufacture Practice),對藥品生產的各個環節,從原料采購、藥品生產、質量檢驗以及藥品銷售等過程均有監管,是國際通用的藥品生產質量管理標準。1988 年以來我國衛生部開始推行GMP 規范認證,1998 年進行了第一次升級,把對藥品企業的GMP 認證標準適度進行了提高。1998 年GMP 修訂版認證于2004 年6 月底結束,共有3101 家企業通過認證,但2011 年為止,按1998 年修訂藥品GMP 認證企業共有 19107條記錄,這一階段GMP 認證的獲得率已經較高。
為此,為進一步促進我國藥品產業健康發展,2011 年食藥監總局又一次研究修訂GMP標準,更加向世界衛生組織、歐盟等國際先進標準邁進,對藥品生產的要求進行較大幅度的提升。按照食藥監總局《關于貫徹實施<藥品生產質量管理規范>的通知》規定,我國的全部藥品將分兩批分別進行新GMP 認證:第一批無菌藥品生產企業應于2013 年12 月31 日前達到新修訂藥品GMP 要求,第二批其他全部藥品生產企業應于2015 年12 月31 日達到新修訂藥品GMP 要求。
GMP 標準修訂前后企業數量
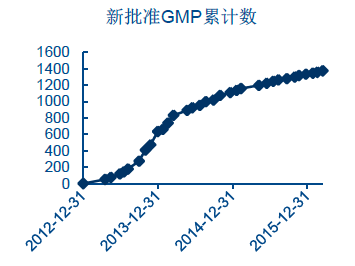
啟動新GMP 以來的認證情況
2、新GMP 標準的推廣會導致大量中小藥企被迫退出
新GMP 給企業預留的四年時間窗口已結束,預計后續將有約30%的藥企被迫退出。從歷史數據看,如圖10 所示,我國第一次實施1998 年版GMP 認證后,25%的藥企直接退出了市場。新GMP 實施后,第一批無菌藥品生產企業數量也出現了顯著下滑。根據2013 年底的數據,我國無菌藥品生產企業共計1319 家,而提出了新GMP 認證申請的只有870 家,占比66%,最終通過檢查的只有796 家,占比60.3%。而對于更大規模的其他全部藥品生產企業,食藥監總局在制度頒發時預留了四年時間窗口,制度在2011 年頒發,但2015 年12 月31 日才是檢驗的最終期限。
事實上,據測算,新GMP 提出的生產線改造費用較高,改造一條生產線的平均支出約為500 萬。按照10%平均凈利率算,對于產值在5000 萬及以下的藥企來說,改造一條生產線的費用就超過了企業一年的盈利,而從食藥監局曾公布的數據可以估算中小藥企平均擁有生產線數為3 條。因此,大量中小藥企在面臨“是花費三年凈利潤改造工廠以達新標,還是關門停產”的時候會選擇后者。事實上,很多中小藥企在過去幾年所做的事情是增加生產、補充庫存,這樣在2015 年底大限來臨之后,仍能有部分庫存可用于銷售。因此,從進入2016 年開始,大量不滿足新GMP 標準的中小藥企開始進入停產去庫存階段,一旦這個過程結束,企業將面臨關停或出售的局面。
二、針對新藥開啟史上最嚴臨床數據核查,影響企業未來現金流預期
針對新藥品種,食藥監總局開啟了一輪史上最嚴格的臨床數據核查。2015 年8 月國務院發布《關于改革藥品醫療器械審評審批制度的意見》,著重強調了要提高我國藥品審批標準。和《意見》大約同時期,國家食藥監總局發布了《關于開展藥物臨床試驗數據自查核查工作的公告》。《公告》強調,為從源頭上保障藥品安全、有效,國家食品藥品監督管理總局決定,對已申報生產或進口的待審藥品注冊申請開展藥物臨床試驗數據核查,以著力解決我國一部分“新藥”臨床質量不高、數據部分造假、注冊申請積壓等一系列問題。
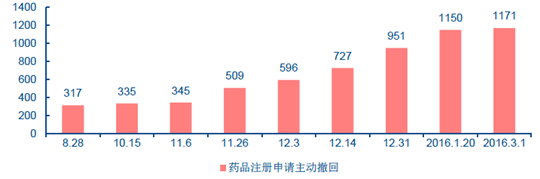
“史上最嚴”核查導致大量排隊注冊申請撤回,直接影響企業的未來現金流預期。此輪核查的嚴格程度超過了此前市場的預期。2015 年底,CFDA 公布了兩輪抽查的審查結果,對于抽檢的11 個企業的24 個藥品注冊申請,臨床試驗數據全部有問題,不予批準相關注冊。抽查中的100%拒絕率嚇退了整個行業,絕大多數企業陸續撤回了新藥注冊申請。《關于開展藥物臨床試驗數據自查核查工作的公告》發布時,排隊注冊申請的共有1622 個藥品品種,而根據CFDA 網站公告總結,截止目前1622 個品種中,除去193 個不需要臨床試驗的藥品品種,共有1171 個品種撤回,占比高達81.9%。研發一個新藥的投入成本非常高,根據新三年來新藥研究成本的交易價格通常在3000 萬元以上,一些醫藥專家的估算更高,認為中國研發一個新藥平均成本在2 億元左右。因此,市場對于一些研發接近尾聲、申請獲批等待生產的藥企有著較為樂觀的未來預期,如果申請被拒或主動撤回,都會對現金流預期帶來較大負面影響,對于沒有實質研發能力的企業無疑是巨大沖擊。
開展臨床試驗后主動申請撤回的藥品品種愈發增多
1、食藥監總局今年開始大力推動仿制藥一致性評價
一致性評價是一種發達國家都廣為采用的仿制藥行業發展標準,特別是美國公布了一份經生物等效性評價合格的已批準上市的藥品名錄,即《經治療等同性評價批準的藥品》,被業界稱為橙皮書“Orange Book”,為臨床使用生物等效的仿制藥替代原研藥提供了依據,是全球醫藥行業一致性評價的鼻祖。“橙皮書”列舉了FDA 批準的藥品,并指出所謂“等效性概念”應包括制劑等效性、同成分異含量制劑、治療等效性、生物利用度、生物等效制劑等,其中治療等效性決定了仿制藥與原研藥之間的是否一致。
整體上看,世界各國推廣一致性評價都會顯著淘汰不合格藥品。20 世紀70 年代美國進行了生物等效性評價,淘汰了約6000 種不合格藥品。1975 年,英國重新審查評價了1968年藥品法出臺之前上市的3 萬多種藥品。1998 年日本啟動了“藥品品質再評價工程”,目前仍在持續進行中,至今該工程共完成了730 多個品種、7000 多個產品的質量一致性和有效性再評價,400 多個不達標的批準文號被注銷,產品退出市場。
2、不斷完善監管機構自身隊伍建設
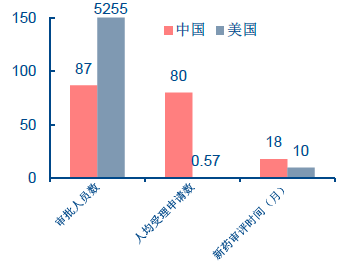
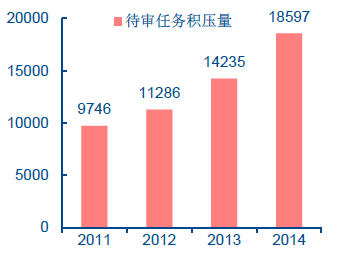
一直以來,我國食藥監本身能力相對不足,技術審評人才嚴重缺乏。美國FDA 有審評人員5255 人,占FDA 總人數的45.6%,每年審批申請近3000 件。而我國國家藥品審評中心共有120 人,其中專業審評員87 人,每年平均受理6000 個審評申請,平均每人每年要完成近80 個項目的審評,實際上根本無法完成,造成大量申請積壓。2014 年我國待審任務積壓為18597 件,比2013 年待審任務總量增加了4362 個,上漲了1/3。我國新藥臨床試驗申請和上市申請的法定時限分別為90 天和150 天,仿制藥申請的法定時限為160 天,而實際新藥臨床試驗申請和上市申請的等待時間分別為8.1 個月和1 年半,仿制藥申請等待時間更是長達3 年。因此,加強食藥監總局的人才建設、增加人員編制數量、提高激勵水平等刻不容緩。
中美藥品審評機構能力對比
中國食藥監總局擠壓申請情況嚴重
2016 年3 月19 日,在國務院發展研究中心主辦的中國發展高層論壇上,國家食品藥品監督管理總局藥品化妝品注冊管理司司長王立豐表示,CDFA 目前正在進行機構和人員調整的相關準備工作,特別是對國家藥品審評中心,將從全球招募技術人員以增強監管機構審核能力。同時,各地方食藥監局也有很多人才建設的積極探索。例如,湖南省食藥監局將強化人才隊伍建設作為2016 年“五大項目事實”之一,全面推進人才強局戰略,在全省系統內分層分類大規模開展業務培訓。
3、簡政放權,提高監管效率
整體上看,監管機構本身的改革方向是“有收有放”,即對于前文提到的創新藥臨床數據核查、仿制藥一致性評價等重磅政策由國家食藥監總局全權負責,同時通過簡政放權并把一些監管權限下放到省級單位,這樣有助于發揮省級單位力量,整體提高監管效率。
2013 年以來國家涉及藥品改革的政策梳理
日期發布部門文件名稱核心內容2013 年2 月國家食品藥品監督管理局關于深化藥品審評審批改革進一步鼓勵藥物創新的意見進一步加快創新藥物審評,實行部分仿制藥優先審評,加強藥物臨床試驗質量管理,鼓勵研制兒童用藥,制定配套措施,注重協調配合2013 年6 月國家食品藥品監督管理局調整部分醫療器械變更審批和質量管理體系檢查職責將部分境內第三類醫療器械注冊證書和第三類體外診斷試劑登記的變更審批事項等工作調整至省級食品藥品監督管理部門實施2013 年10 月國家食品藥品監督管理局加強省級醫療器械技術審評能力建設的指導意見力爭通過2~3 年的時間,省級醫療器械技術審評能力逐步提高,審評人員配置合理,規章制度不斷完善,信息化水平不斷提高,以實現制度化、規范化、科學化的審評工作目標2013 年12 月國家食品藥品監督管理局關于2013 年度仿制藥質量一致性評價方法研究任務的通知各省級藥品監督管理部門要加強宣傳,廣泛動員,引導有關各方積極參與到該項工作中2014 年2 月國家食品藥品監督管理局創新醫療器械特別審批程序(試行)在確保上市產品安全、有效的前提下,針對創新醫療器械設置的審批通道2014 年4 月國家食品藥品監督管理局關于做好部分特殊藥品行政審批項目下放相關工作的通知將區域性批發企業跨省向醫療機構銷售麻醉藥品和第一類精神藥品審批的實施機關由國家食品藥品監管部門下放至省級食品藥品監管部門2014 年9 月國家食品藥品監督管理局公布第一批過度重復藥品品種目錄提醒社會投資方和相關企業,注意評估研發風險,慎重進行投資經營決策2015 年1 月國家食品藥品監督管理局關于做好全面實施藥品電子監管工作的通知加強藥品生產經營企業入網的組織管理,加強藥品電子監管工作力度,盡快實現電子監管全品種全鏈條覆蓋2015 年6 月國家食品藥品監督管理局關于對取消和下放行政審批事項加強事中事后監管的意見明確取消和下放的行政審批事項,統一規范審批標準,強化承接能力建設,嚴格審批備案和事后評估,深化監管信息公開,依法依紀嚴肅問責等2015 年7 月國家食品藥品監督管理局關于做好特殊藥品定點生產審批和監管工作的通知將麻醉藥品、第一類精神藥品和第二類精神藥品原料藥定點生產審批,第一類中的藥品類易制毒化學品生產許可審批的實施機關由食品藥品監管總局下放至省級食品藥品監督管理部門2015 年8 月國家食品藥品監督管理局關于印發醫療器械經營企業分類分級監督管理規定的通知食品藥品監督管理部門根據醫療器械的風險程度、醫療器械經營企業業態、質量管理水平和遵守法規,不良事件及產品投訴狀況等因素,將醫療器械經營企業分為不同的類別,并按照屬地監管的原則,實施分級動態管理2015 年8 月國務院關于改革藥品醫療器械審評審批制度的意見提高藥品審批標準,推進仿制藥質量一致性評價,加快創新藥的審評審批,開展藥品上市許可持有人制度試點,及時發布藥品供求和申報信息,改進藥品臨床試驗審批等2015 年11 月國家食品藥品監督管理局關于藥品注冊審評審批若干政策的公告提高仿制藥審批標準,規范改良型新藥的審評審批,優化臨床試驗申請的審評審批,實行同品種集中審評,允許申請人主動撤回不符合條件的藥品注冊申請等2015 年11 月國家食品藥品監督管理局關于現有從業藥師使用管理問題的通知實施從業藥師過渡政策:延長具備條件的從業藥師資格有效期,確認具備條件的從業藥師,過渡期從業藥師的使用和管理2016 年2 月國家食品藥品監督管理局關于解決藥品注冊申請積壓實行優先審評審批的意見為加強藥品注冊管理,加快具有臨床價值的新藥和臨床急需仿制藥的研發上市,解決藥品注冊申請積壓的矛盾,提出優先審評審批的范圍、程序和工作要求2016 年3 月國務院關于開展仿制藥質量和療效一致性評價的意見明確評價對象和時限,確定參比制劑遴選原則,合理選用評價方法,落實企業主體責任,加強對一致性評價工作的管理,鼓勵企業開展一致性評價工作鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息之目的,如有侵權行為,請第一時間聯系我們修改或刪除,郵箱:cidr@chinaidr.com。


